Fig 01 – Martin, 1901
HISTÓRIA DA CIRURGIA DA ACALÁSIA DO ESÔFAGO E DO MEGAESÔFAGO CHAGÁSICO
Joffre M. de Rezende*
Introdução
O autor faz uma revisão histórica da evolução do tratamento cirúrgico da acalásia idiopática do esôfago e do megaesôfago chagásico. As duas entidades, que só diferem entre si quanto à etiologia, são consideradas como uma única afecção no referente ao tratamento cirúrgico.
Para uma abordagem didática, os diferentes tipos de operação propostos foram separados em 11 grupos, levando em consideração a semelhança técnica e seu embasamento teórico. Em razão do desconhecimento da fisiopatologia da acalásia, a conduta cirúrgica adotada no passado variou de acordo com a interpretação de cada cirurgião sobre a natureza da afecção, dando origem a uma grande variedade de operações, a maioria das quais têm hoje apenas interesse histórico.
Somente após a aquisição de conhecimentos científicos sobre a patogênese e a fisiopatologia da afecção, o tratamento cirúrgico alcançou o estádio atual. Aceita-se atualmente a cardiomiotomia com algum tipo de fundoplicatura parcial como a operação mais indicada para os casos não avançados de megaesôfago. Para os casos em que há grande dilatação e alongamento do esôfago ainda não há consenso entre os cirurgiões sobre a melhor conduta cirúrgica a ser adotada.
O autor ressalta a grande experiência e contribuição dos cirurgiões brasileiros para o progresso do tratamento cirúrgico do megaesôfago, seja aprimorando as técnicas já existentes, seja criando novas técnicas.
A acalásia idiopática do esôfago e o megaesôfago chagásico são duas entidades que só diferem entre si quanto à etiologia. As manifestações clínicas, a fisiopatologia e os aspectos radiológicos, endoscópicos e manométricos são idênticos, e o tratamento, qualquer que seja o método adotado, aplica-se igualmente a ambas as afecções.
Assim sendo, nesta retrospectiva histórica consideraremos as duas condições como sendo uma única no referente ao tratamento cirúrgico.
A acalásia do esôfago constituía no passado verdadeiro enigma para a medicina e numerosas teorias foram aventadas para explicá-la. Em decorrência desse fato o próprio nome da afecção variou ao longo do tempo. Em uma revisão da literatura, Vaz encontrou nada menos que 71 diferentes denominações (89). Uma das denominações que prevaleceu por muito tempo e, por vezes, ainda é usada, é a de cardioespasmo, dada por Mikulicz em 1882 (13).
A denominação de acalásia foi adotada em substituição à de cardiospasmo a partir do trabalho clássico de Hertz, de 1914/1915, em razão de não haver espasmo da cárdia e sim falta de relaxamento do esfíncter inferior do esôfago às deglutições (Do grego a, negação + chálasis, relaxamento (34). Hertz, mudou o seu próprio nome para Hurst em suas publicações posteriores, razão pela qual a teoria da acalásia passou a ser citada como teoria de Hurst. O trabalho mais citado na literatura é o de Hurst e Rake, datado de 1930 (37).
O nome de megaesôfago, adotado por Von Hacker em 1907, além do seu significado etimológico de uso universal, é usado no Brasil desde a década de 1930 para nomear especificamente a esofagopatia endêmica de etiologia chagásica, popularmente conhecida como mal de engasgo (13).
Em conseqüência do desconhecimento da fisiopatologia da acalásia, a conduta cirúrgica adotada no passado para o seu tratamento variou de acordo com a interpretação de cada cirurgião sobre a patogenia desta afecção, dando origem aos mais diversos procedimentos e técnicas, muitos dos quais têm hoje apenas interesse histórico.
No século XIX a única operação empregada consistia em uma simples gastrostomia com a finalidade de alimentar o doente nos casos de desnutrição grave (19).
Ao iniciar o século XX começam a ser utilizadas outras modalidades de intervenção cirúrgica no tratamento da acalásia. Os diferentes tipos de operação e os fundamentos que os inspiraram foram objeto de análise por Steichen et al. (81), Ochsner e DeBakey (53), Ellis e Olsen (19) e Ximenes Netto (93), em excelentes revisões.
Não seguimos nenhuma das classificações apresentadas por estes autores, preferindo uma abordagem mais simples e didática, levando em conta a semelhança técnica e o embasamento teórico das operações realizadas. Com este propósito os diferentes tipos de operação foram reunidos nos seguintes grupos:
Dilatação cirúrgica
Russell (1898), na Inglaterra, idealizou e construiu o primeiro balão pneumático, que poderia ser introduzido pela boca, desinsuflado, até alcançar o estômago e, a seguir inflado, distendendo a cárdia (73).
Plummer (1906), nos EE.UU., desenvolveu um modelo de balão hidrostático em que a distensão é feita com água em lugar de ar (59).
Os resultados satisfatórios obtidos com a dilatação pelo balão pneumático ou hidrostático deram origem à idéia de se proceder à dilatação cirúrgica, que poderia ser feita sob visão direta e não às cegas.
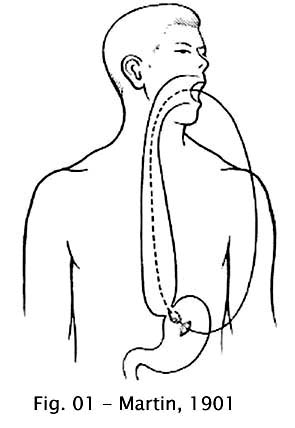
Martin (1901) procedeu a dilatação anterógrada e retrógrada através de gastrostomia, com uma oliva semelhante à usada para dilatação de estenose cicatricial do esôfago por ingestão de cáustico (47). O paciente era alimentado pela gastrostomia, pois, em sua opinião, o esôfago deveria ficar em repouso durante o período de tratamento.

Fig 01 – Martin, 1901
Mikulicz (1904) descreveu a técnica por ele empregada, segundo a qual a dilatação era feita inicialmente por meio de uma pinça introduzida através de uma incisão na parede anterior do estômago. A pinça era introduzida fechada até alcançar o esôfago e, a seguir, aberta. Após a distensão com a pinça, a dilatação era completada manualmente (57).
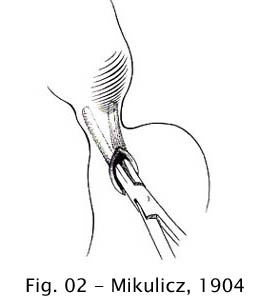
Fig 02 – Mikulicz, 1904
O método encontrou adeptos em outros cirurgiões, muitos dos quais faziam apenas a dilatação digital. Em 1940, Ochsner e DeBakey coletaram na literatura mundial 80 casos assim tratados, com mortalidade de 8,9% e resultados satisfatórios em 70,8% dos casos (53).
Barrow, citado por Wakeley, em 1915, utilizou a técnica da dilatação digital, invaginando a parede anterior do estômago e evitando, assim, a abertura do estômago (90). Esta técnica foi posteriormente adotada por Kümmel em 1921 (43).
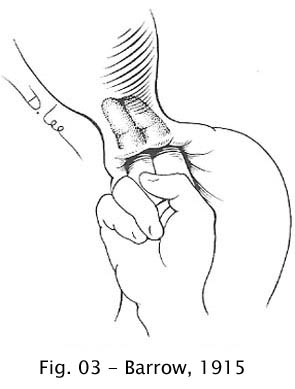
Fig 03 – Barrow, 1915
Anschütz (1921) praticava a dilatação da cárdia com um balão, porém abria o abdome para posicionar corretamente o balão (2).
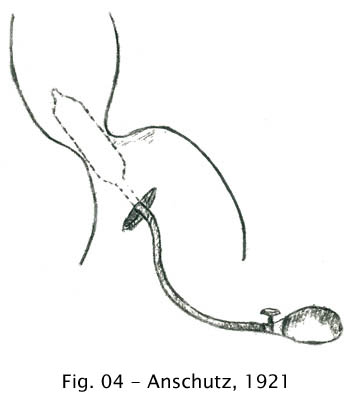
Fig 04 – Anschutz, 1921
Como os resultados obtidos com a dilatação cirúrgica fossem equivalentes aos da dilatação peroral, esta passou a ser preferida. O tratamento cirúrgico permaneceu como alternativa e como solução para os casos de insucesso da dilatação. Veremos, a seguir, as diversas modalidades de operações que foram ou são utilizadas no tratamento da acalásia.
Operações para redução do diâmetro do esôfago
Reisinger (1907) criou uma técnica para reduzir o diâmetro do esôfago na acalásia, retirando uma faixa da parede do esôfago, de cerca de 15 cm de comprimento por 2 a 3 cm de largura e suturando as bordas (67).
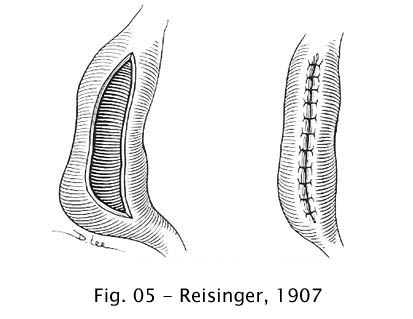
Fig 05 – Reisinger, 1907
Recentemente o procedimento de reduzir o diâmetro da esôfago voltou a ser utilizado nos casos de megaesôfago avançado como complemento da cardiomiotomia (56).
Meyer (1911), em lugar de
abrir o esôfago, procedia a uma plicatura da parede esofagiana, com
o que reduzia a sua luz (50).
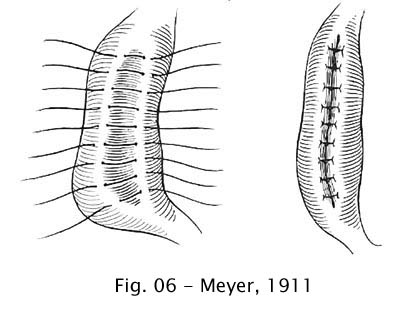
Fig 06 – Meyer, 1911
Operações para encurtamento do esôfago
Para os casos em que o esôfago, além de dilatado, apresentava-se alongado, Tuffier, (1922) e Freeman (1923) idealizaram encurtar o esôfago por invaginação de sua parede (25, 85). Na técnica de Tuffier, a invaginação era feita no esôfago cervical enquanto Freeman a realizava no segmento distal infradiafragmático, após liberar e tracionar o esôfago para o abdome.
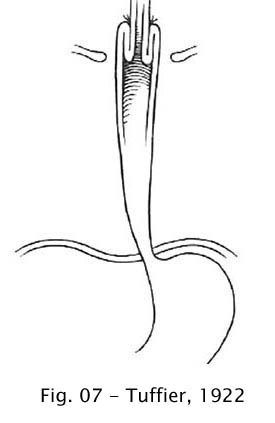
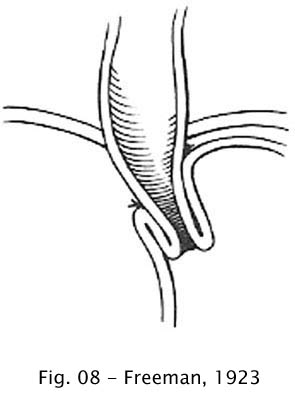
Fig 07 – Feeman, 1923 Fig 08 – Tuffier, 1922
Kay (1953) associava a cardioplastia de Wendel com a tração do esôfago para o abdome, refazendo o hiato acima da cárdia (39).
Ciaglia e Segal (1962) empregaram
e recomendaram a ressecção segmentar do esôfago distal
com anastomose termino-terminal (12).
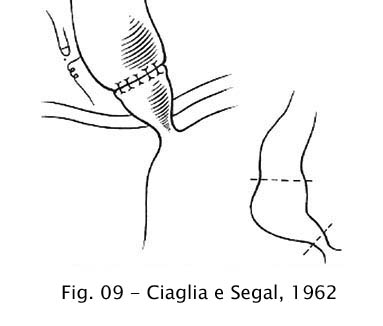
Fig 09 – Ciaglia e Segal, 1962
Operações sobre o diafragma
Roepke (1914), acreditando que a obstrução fosse causada por uma periesofagite, liberava a junção esofagogástrica de todos os tecidos que circundavam o esôfago e a cárdia e alargava o hiato com uma incisão no diafragma (72).
No Brasil, Vampré (1919) admitiu que a causa do megaesôfago fosse um espasmo do diafragma, o que levou Camargo a praticar a secção dos pilares do diafragma em seis pacientes (86). Em face dos maus resultados, a teoria do espasmo diafragmático foi abandonada pelo próprio Vampré, quatro anos depois ( 87 ).
Gregoire (1923), igualmente convencido de que o diafragma participava de maneira importante da obstrução, associava a cardioplastia com a incisão do diafragma, alargando o hiato, procedimento este batizado de "frenotomia" e que foi adotado por outros cirurgiões, especialmente na França.
Operações sobre a inervação extrínseca do esôfago
Uma das teorias etiopatogênicas sugeridas procurava explicar a acalásia como decorrente de uma alteração da inervação extrínseca do esôfago. Era natural, portanto, que se procurasse atuar cirurgicamente nessa inervação.
Sauerbruch (1921) realizou vagotomia bilateral em 4 casos de acalásia, sem registrar melhora clínica dos pacientes (75).
Rieder (1929) praticou a vagotomia distal bilateral no tratamento da acalásia e os pacientes vagotomizados tiveram que ser posteriormente reoperados pela técnica de Heller (70).
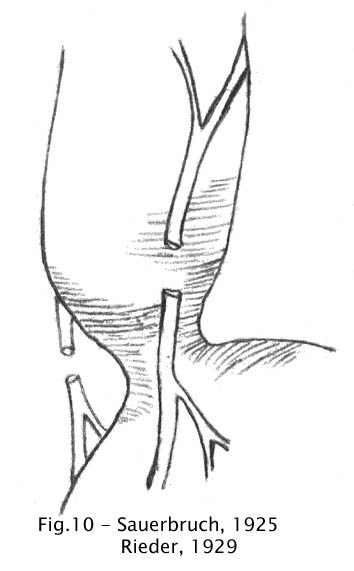
Fig 10 – Sauerbruch, 1925, e Rieder, 1929
Recalde (1932) atribuía a afecção à inervação intrínseca e advogava a neurólise do plexo mientérico de Auerbach no segmento inferior do esôfago, fazendo a descorticação da camada muscular longitudinal, com secção dos nervos vagos. Relatou melhora clínica em 3 casos e um óbito por perfuração do esôfago e mediastinite (66).
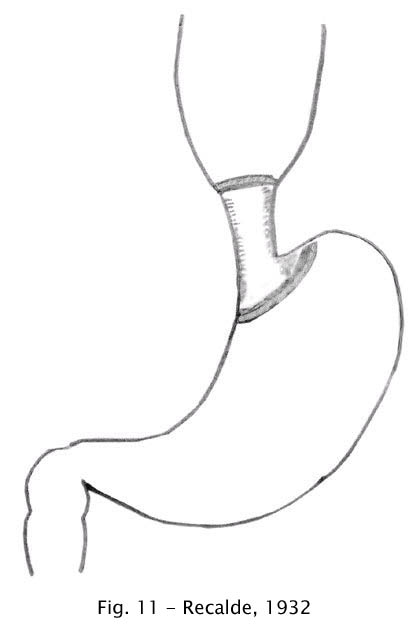
Fig 11 – Recalde, 1932
Segundo Ochsner e DeBakey, até 1940 onze pacientes de acalásia haviam sido submetidos à vagotomia. Houve 3 óbitos; 7 pacientes tiveram recidiva ou agravamento dos sintomas e somente um paciente se beneficiou aparentemente com a intervenção (53).
A vagotomia só se justificaria com o propósito de reduzir a secreção ácida do estômago na prevenção da esofagite de refluxo, mas não como tratamento da acalásia. Já Rake havia demonstrado a existência de alterações inflamatórias e degenerativas do plexo mioentérico (37). O próprio Rieder, que havia praticado a vagotomia em 1929, reconheceu dois anos depois a impropriedade deste procedimento, visto que a vagotomia em animais dificulta o esvaziamento do esôfago, interferindo com o reflexo de abertura do esfíncter inferior do esôfago.
Knight (1934) verificou que a vagotomia bilateral no gato produzia uma condição semelhante à acalásia, a qual regredia pela neurólise da inervação simpática (41). Baseados neste experimento, Knight e Adamson (1935) realizaram a gangliectomia celíaca em cinco casos de acalásia, relatando melhora sintomática em dois deles (42).
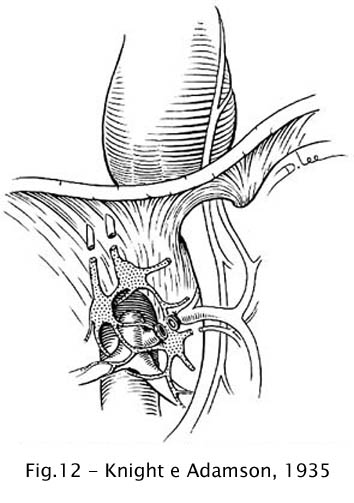
Fig 12 – Knight e Adamson, 1935
Craig et al. (1934) procederam a desnervação simpática, ressecando bilateralmente os gânglios cervicais e torácicos do simpático (15).
A secção do nervo frênico foi praticada em dois casos de acalásia por Enderlen (1929), sem nenhum proveito para os pacientes.
Em face dos maus resultados e com a evolução dos conhecimentos sobre a fisiopatologia da afecção, as operações sobre a inervação do esôfago como procedimentos isolados foram inteiramente abandonadas.
Cardiectomia com anastomose direta
A ressecção do segmento distal do esôfago incluindo a junção esofagogástrica e o restabelecimento do trânsito por anastomose esofagogástrica foi introduzida no tratamento cirúrgico da acalásia por Bier, em 1920 (8). Outros cirurgiões seguiram a mesma trilha, com variantes.
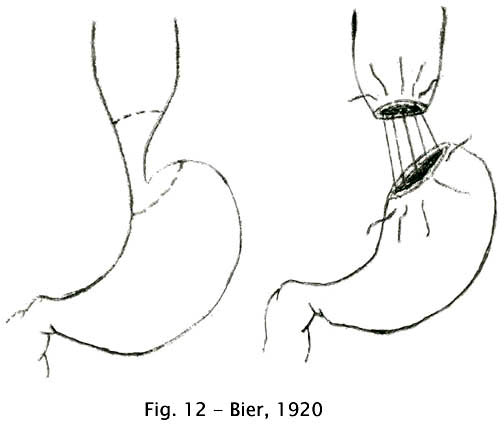
Fig 13 – Bier, 1920
Radlinski (1936), em lugar de simples anastomose, invaginava o segmento distal do esôfago para dentro do estômago (61).
Wangensteen (1951) defendeu o que ele chamou de "operação fisiológica para o mega-esôfago" e que consistia na ressecção conjunta do segmento distal do esôfago e do estômago proximal, associada à piloroplastia (91). Os resultados desta operação foram animadores inicialmente, porém a mesma foi abandonada pelos inconvenientes de uma gastrectomia proximal.
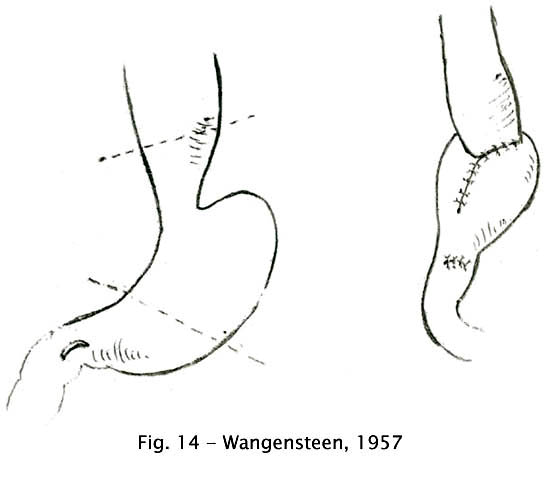
Fig 14 – Wangensteen, 1951
Cardiectomia com interposição de alça
Merendino e Dillard (1955) descreveram a operação que ficou conhecida como operação de Merendino e que consiste na cardiectomia seguida da interposição de um segmento de alça jejunal entre o esôfago e o estômago, considerando que a mucosa jejunal suporta melhor o refluxo ácido do que a mucosa do estômago (49).
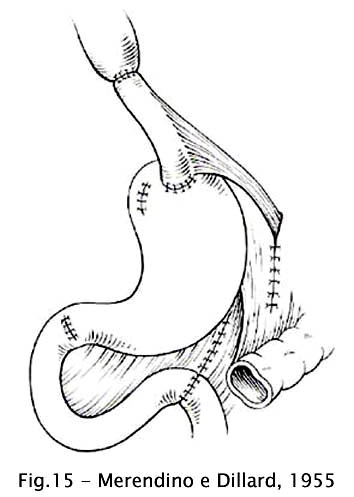
Fig 15 – Merendino e Dillard, 1955
Este tipo de operação teve boa aceitação por parte dos cirurgiões brasileiros para o tratamento do megaesôfago, tanto em casos submetidos anteriormente a outro tipo de tratamento, com recidiva dos sintomas ou esofagite de refluxo, como método preferencial nos casos ainda não tratados. As maiores casuísticas com interposição jejunal no tratamento do megaesôfago chagásico são a de Lázaro da Silva, com 170 casos operados entre 1963 e 1982 (79); a de Resende, que relatou 117 casos operados até 1973 (68), a de Rassi, com 56 casos operados no período de 10 anos (1967-1877), e a de Raia et al., com 39 casos operados até 1983 (62).
Couto e Aldrovando (1966) realizaram operação semelhante, substituindo o segmento jejunal por um segmento de cólon (14).
Barbosa et al. (1971), da Universidade de Brasília, idealizaram e realizaram em 14 pacientes de megaesôfago chagásico a cardiectomia com interposição ileocecal (5).
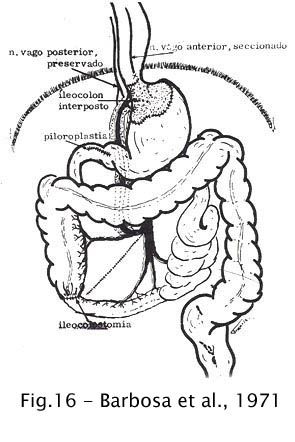
Fig 16 – Barbosa et al., 1971
O racional desta operação era de que a papila ileocecal tem uma função valvular e poderia substituir a cárdia na prevenção do refluxo. Nos casos acompanhados pelos autores não ocorreu esofagite péptica. Por suas dificuldades técnicas e morbidade potencial, esta operação foi abandonada.
Cardioplastias
As cardioplastias tiveram início com a operação de Wendel (1909), inspirada na piloroplastia de Heineke-Mikulicz. Consiste em uma incisão longitudinal de todas as camadas da parede na junção esofagogástrica e fechamento da abertura em sentido transversal (92).

Fig 17 – Wendel, 1909
Outro tipo de cardioplastia utilizada por muitos cirurgiões foi a descrita por Heyrowsky (1913). Na realidade, a operação de Heyrowsky não é propriamente uma cardioplastia e sim uma anastomose da parede lateral do esôfago distal com o fundo gástrico, razão por que, em alguns trabalhos, é denominada esofagogastrostomia (35).
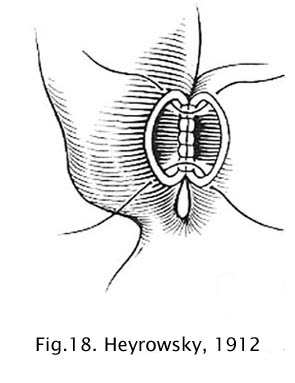
Fig 18 – Heyrowsky, 1913
Surgiram a seguir algumas operações similares visando a corrigir o inconveniente da retenção de ingestas entre a anastomose esofagogástrica lateral e o orifício cárdico.
Lambert (1913) esmagava o esporão com uma pinça, que permanecia no local até o nono dia de pós-operatório, quando era retirada (44). Keller (1928) substituiu a pinça por um fio de categute resistente (40).
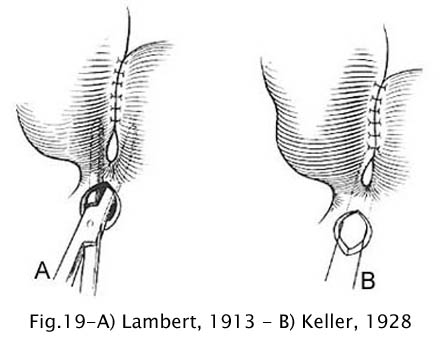
Fig 19 - A – Lambert 1913. B – Keller, 1928
A variante mais difundida para corrigir o inconveniente mencionado foi a descrita por Backer-Gröndhal (1916), na qual a incisão longitudinal é substituída por uma incisão curva passando pela junção esofagogástrica (4).

Fig 20 – Backer-Gröndahl, 1916
O resultado imediato das cardioplastias mostrou-se muito satisfatório do ponto de vista clínico, com melhora ou mesmo desaparecimento da regurgitação e da disfagia. O seguimento dos pacientes operados a médio e longo prazo demonstrou, no entanto, os inconvenientes deste tipo de operação pela ocorrência da esofagite de refluxo, de evolução progressiva, em praticamente todos os casos
Barrett e Franklin (1949), em trabalho que se tornou clássico, documentaram a presença de esofagite em 24 de 25 pacientes submetidos anteriormente à esofagogastrostomia ou cardioplastia. Apenas três deles estavam assintomáticos. Os autores recomendaram que se abandonasse de vez as cardioplastias, substituindo-as pela cardiomiotomia (7).
Dados similares foram relatados por Ripley et al. (1952). De 29 pacientes submetidos à esofagogastrostomia ou à cardioplastia na Mayo Clinic, entre 1935 e 1950, por diferentes afecções esofagianas, 28 apresentaram esofagite pós-operatória decorridos dois meses a quatro anos após a operação. Deste total, sete eram casos de cardiospasmo (acalásia) (71).
A esofagite de refluxo é particularmente grave no megaesôfago operado pela falta do peristaltismo para remover o líquido ácido refluído do estômago, o qual permanece por longo tempo em contato com a mucosa esofagiana.
Outros autores alertaram para o problema e as citadas gastroplastias, como procedimentos isolados, foram sendo aos poucos abandonadas ou associadas a outros tipos de intervenção.
Frejat (1974), para prevenir a esofagite de refluxo, associou a gastroplastia de Wendel à fundoplicatura de Nissen, tendo relatado 50 casos operados com bons resultados (26).
Guarner e Gaviño (1983) associaram a operação de Heyrowsky com a fundoplicatura à Nissen em 6 casos que haviam sido submetidos anteriormente à cardiomiotomia e que apresentaram recidiva dos sintomas. Os pacientes foram acompanhados durante 6 meses e os resultados foram satisfatórios (32).
Thal et al. (1965) descreveram um novo tipo de cardioplastia em que se cria um mecanismo valvular que impede ou dificulta o refluxo. Destinada inicialmente à reconstrução da cárdia em casos de ruptura do esôfago inferior e estenose esofagiana, passou a ser posteriormente empregada na estenose esofagiana e na acalásia.
Consiste basicamente em uma abertura de todas as camadas da parede, que se estende 3 a 6 cm acima e 2 a 3 cm abaixo da cárdia em direção à grande curvatura gástrica. Resulta uma brecha que é fechada rebatendo-se sobre ela a parede anterior do fundo gástrico.
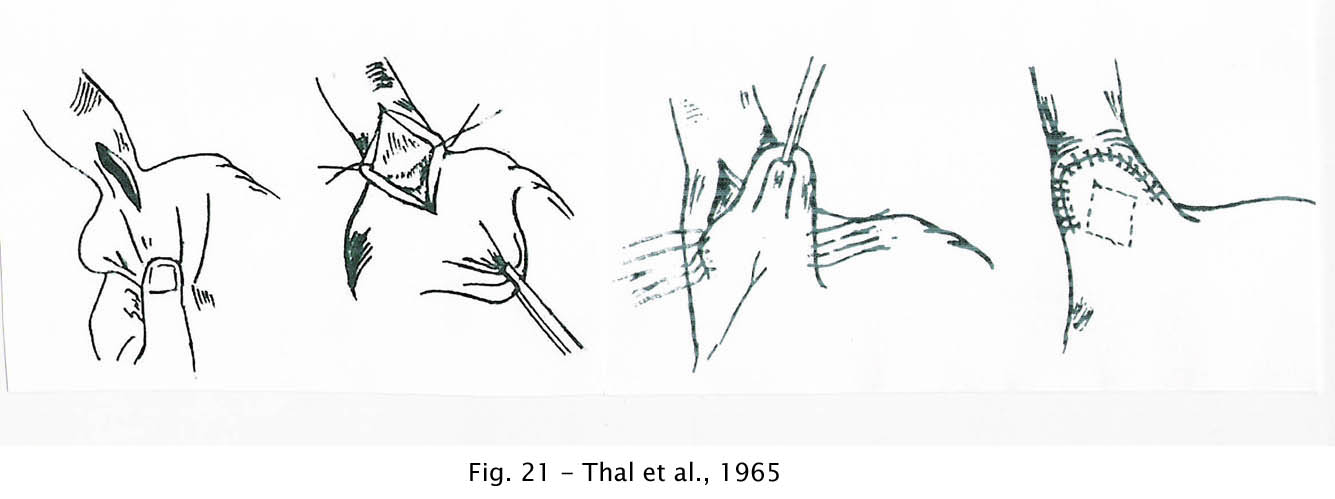
A superfície serosa da parede gástrica que fica voltada para a luz do esôfago, com o passar do tempo, é recoberta pelo epitélio escamoso regenerado do esôfago (82).
A operação de Thal-Hatafuku foi adotada no Brasil para o tratamento do megaesôfago chagásico por vários cirurgiões, que aprimoraram sua técnica e adquiriram grande experiência com a mesma. As maiores casuísticas relatadas são a de Barbosa et al. (1987), com 351 casos operados ( 6), a de Ximenes Netto (1987), com 210 casos (93), a de Malafaia (1991), com 111 casos. (46 ) e a de Sader et al. (1975) com 50 casos.(74).
França et al. descreveram outra modalidade de cardioplastia a que denominaram esofagocardiomioplastia transversal extra-mucosa com esofagogastrofundoplicatura parcial.
Consiste em associar a técnica de Girard com a fundoplicatura parcial segundo Toupet-Lind. Relataram 215 casos operados até 1999 com bons resultados (24).
Petrovsky (1962), na Rússia, descreveu um novo tipo de operação a que chamou de diafragmoplastia. Inicia-se com uma incisão na camada seromuscular da parede do esôfago em forma de T, seguida de descolamento das bordas laterais triangulares, que são ressecadas. Resulta uma brecha com exposição da mucosa esofagiana em uma extensão longitudinal de 6 a 7 cm e transversal em hemicircunferência. A superfície cruenta é recoberta por um retalho pediculado do diafragma e a abertura resultante do diafragma é fechada com pontos separados. Quinze pacientes foram operados e acompanhados pelo autor por um período de 2,5 a 3,5 anos, apresentando bons resultados, tanto em relação aos sintomas da acalásia quanto pela ausência de esofagite de refluxo pós-operatória (54).
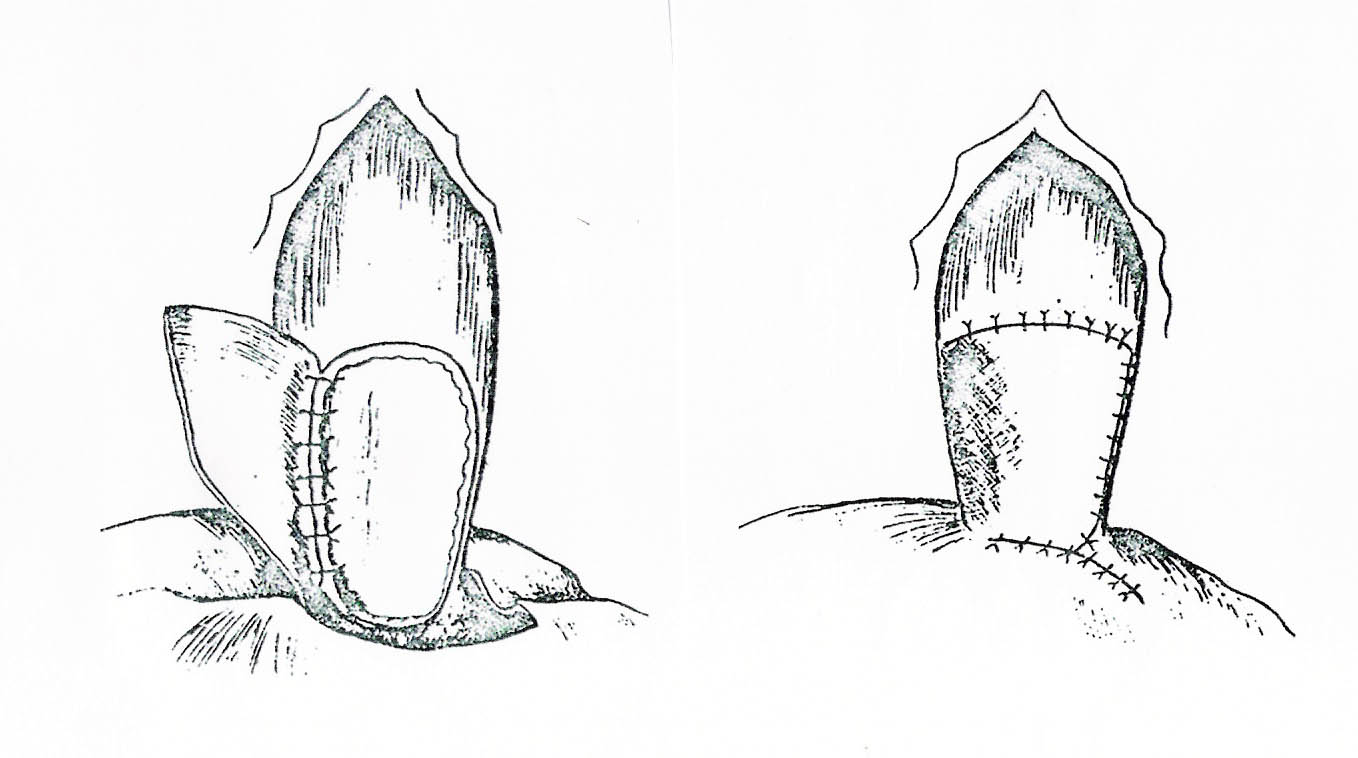
Fig 22 – Petrovsky, 1962
Serra Dória et al. (1968), visando a contornar o problema da esofagite de refluxo nos pacientes operados de megaesôfago adotaram uma nova conduta cirúrgica. Associaram a cardioplastia de Gröndhal à gastrectomia subtotal com reconstituição do trânsito em Y de Roux. Com esta operação não haveria teoricamente secreção de ácido pelo estômago suficiente para causar esofagite nem refluxo de secreção biliopancreática, igualmente agressiva para a mucosa esofagiana.
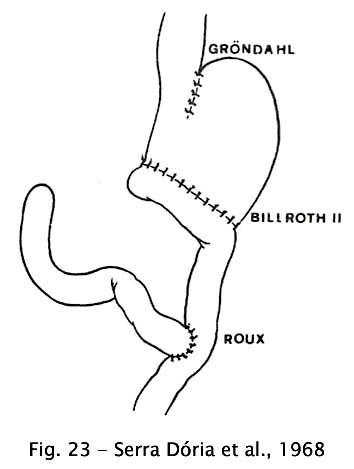
Fig 23 – Serra Dória et al., 1968
Holt e Large (1961) já haviam realizado idêntica operação para o tratamento da esofagite, com e sem estenose. Nos casos sem estenose realizavam a gastroplastia à Gröndahl e nos casos com estenose procediam à ressecção da cárdia e do segmento distal do esôfago, com anastomose esofagogástrica término-terminal. Em todos os casos coplementavam a operação com vagotomia. De 11 casos operados, seis eram de acalásia, que já haviam sido operados anteriormente pela técnica de Gröndahl (36).
Cabe a Serra-Dória, no entanto, a prioridade de ter empregado esta operação pela primeira vez no tratamento cirúrgico do megaesôfago com o objetivo de prevenir e não de tratar a esofagite de refluxo. A vagotomia não é feita na técnica original de Serra-Dória, considerando que no megaesôfago chagásico é comum a hipocloridria.
Goldenberg et al., no entanto, preconizam a vagotomia também no megaesôfago chagásico, tendo-a praticado em 10 casos operados (28).
Em 1973, Serra Dória já contava com 130 casos operados com bons resultados (78).
A operação de Serra Dória tem sido praticada em vários centros cirúrgicos do nosso País e tem sido objeto de estudos na Faculdade de Medicina da Universidade Federal de Goiás e na Santa Casa de Goiânia, tendo sido tema de duas dissertações de mestrado e uma tese de doutorado, que citamos a seguir:
Alves (2003) avaliou os resultados imediatos da operação de Serra Dória em 50 pacientes com megaesôfago avançado, operados no período de 1988 a 2002, 98% dos quais tinham sorologia positiva para Doença de Chagas. A complicação mais importante no pós-operatório imediato foi hemorragia digestiva alta em 5 pacientes (10%). Um paciente faleceu de acidente vascular cerebral no primeiro dia pós-operatório e os demais tiveram alta hospitalar entre o sexto e o nono após a operação.. No trigésimo dia de pós-aoperatório apenas três pacientes (7,5%) ainda se queixavam de disfagia (1).
Trevenzol (2003) analisou retrospectivamente os resultados obtidos com a operação de Serra-Dória em 20 pacieantes que haviam sido previamente tratados por cardiomiotomia e que apresentaram recidiva dos sintomas. Concluiu que a operação de Serra-Dória nesses casos é bem tolerada e proporciona significativa melhora dos sintomas de disfagia, regurgitação e pirose. Verificou aumento do peso corporal em 13 pacientes e redução do calibre do esôfago ao exame radiológico em onze. Dentre nove pacientes que apresentavam esofagite no pré-operatório, houve melhora em seis (84).
Stefani-Nakano (2005) realizou um estudo comparativo entre os resultados tardios da operação de Serra-Dória e os da esofagectomia transdiafragmática com esofagogastroplastia.. Foram avaliados 22 pacientes submetidos à operação de Serra-Dória e 22 à esofagectomia. Para comparação foram utilizados os seguintes dados: sintomatologia, estado nutricional, diversos exames de laboratório, endoscopia e histologia em material de biópsia. A autora conclui que não houve diferença significativa com relação à avaliação clínica, nutricional, laboratorial, endoscópica, histológica e de qualidade de vida. Embora sem significação estatística, registrou maior frequência de esofagite e menor absorção de ferro no grupo tratado com a operação de Serra-Dória (80).
Cardiomiotomia
Modalidade de operação destinada a ser um marco na história do tratamento cirúrgico da acalásia, foi concebida em 1901, por Gottstein, quem não chegou a realizá-la. Coube a Heller, em 1913, a prioridade, ao operar uma paciente de 49 anos, com história de 30 anos de disfagia. Heller havia programado a esofagogastrostomia segundo a técnica de Heyrowsky. Ficou surpreso ao verificar a espessura da camada muscular na junção esofagogástrica, lembrando o piloroespasmo da criança. Decidiu, então, fazer uma operação semelhante à pilorotomia de Ramsted. Incisou a parede muscular anterior e posterior em uma extensão de 8cm, cruzando a junção esofagogástrica com um mínimo de corte na parede gástrica. A camada mucosa ficou livremente exposta nas duas incisões (33).

Fig 24 – Heller, 1913
Apesar da sua simplicidade e eficácia, a cardiomiotomia não foi imediatamente aceita como solução para o tratamento cirúrgico da acalásia, e os cirurgiões, principalmente na Alemanha, pátria de Heller, continuavam preferindo as cardioplastias. No dizer de Steichen et al., Heller foi um profeta sem glória em seu país (81).
Até 1921 haviam sido operados apenas 16 pacientes com esta técnica, por ele e por outros cirurgiões, sem nenhum óbito, e com bons resultados em 12. Em 1932, a literatura registrava 59 casos operados com 13 insucessos e 4 óbitos (19).
Como geralmente ocorre em cirurgia, diversas modificações da técnica original de Heller foram propostas. A primeira delas se deve a Girard (1915) e consistia no fechamento da incisão em sentido transversal tal como na piloroplastia de Heineke-Mikulicz (27).
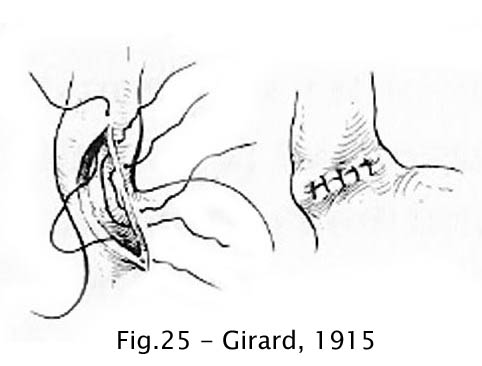
Fig 25 – Girard, 1915
Groenveldt, na Holanda, optou por fazer apenas uma incisão na parede anterior, obtendo resultados equivalentes aos da dupla incisão de Heller (31). Esta modificação firmou-se em caráter definitivo daí por diante no tratamento cirúrgico da acalásia.
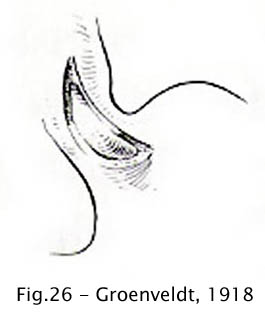
Fig 26 – Groenveldt, 1918
Na França, Fontaine (1950) e outros cirurgiões associaram a cardiomiotomia a algum tipo de neurólise: vagotomia ou esplancnicectomia (23).
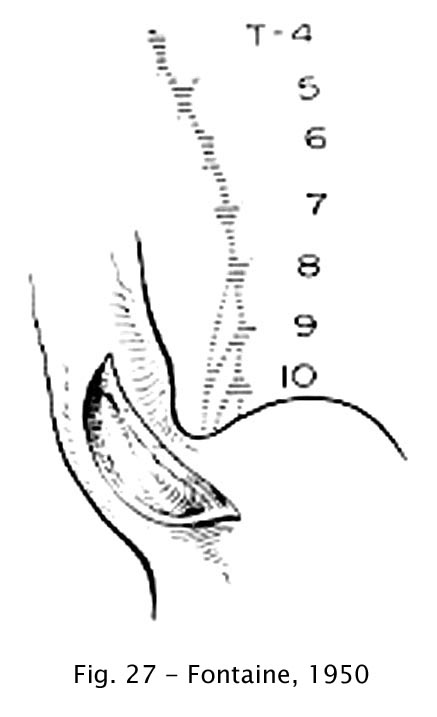
Fig 27 – Fontaine, 1950
Uma das modificações mais relevantes data de 1938 e se deve a um cirurgião brasileiro, Oliveira Mattos, quem passou a fazer a retirada de uma faixa da camada muscular na parede anterior do esôfago, acompanhando a incisão numa extensão de 8 a 10 cm, de modo a alargar a brecha com a superfície exposta da mucosa. Ressaltou ainda Oliveira Mattos a importância de se retirar a submucosa juntamente com a camada muscular (48). Esta técnica tem sido utilizada por numerosos cirurgiões, sendo chamada de cardiomiectomia.
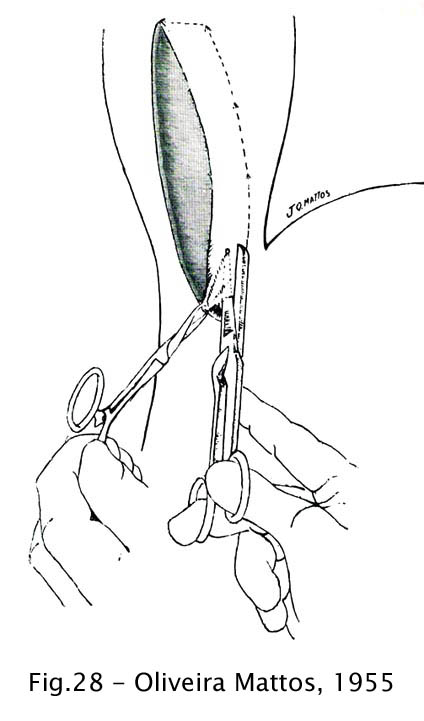
Fig 28 – Oliveira Mattos, 1955
Vasconcelos propôs a retirada da fita muscular na borda direita da face anterior da cárdia, para poupar as fibras oblíquas do estômago, técnica que foi utilizada por Chaib et al., em 200 casos operados até 1977 (10). Insatisfeito com os resultados, Chaib introduziu outra modificação técnica que divulgou em nota prévia publicada em 1983. Consiste em realizar a miotomia na face direita do esôfago, preservando-se as estruturas anatômicas das faces anterior, esquerda e posterior. A incisão estende-se para cima até a parte dilatada do esôfago e, para baixo, até 1cm da parede do estômago, evitando-se seccionar a musculatura gástrica. Sutura-se, a seguir, o pequeno epiploo às bordas da ferida, de modo a recobrir toda a superfície exposta da mucosa, o que, não só evita possível reaproximação das mesmas, como contribui para a fixação do esôfago distal na cavidade abdominal. Por fim, o fundo gástrico é fixado à borda esquerda da incisão por duas fileiras de pontos, formando uma calha de 2 a 3 cm de largura (11).
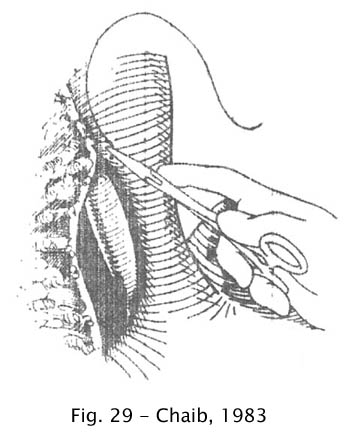
Fig 29 – Chaib, 1983
Desde o início da prática da cardiomiotomia, tem sido usada ou a via de acesso torácica ou a abdominal, com acentuada preferência para esta última. Vários pormenores técnicos foram introduzidos, na dependência do entendimento e da experiência de cada cirurgião.
Pilon et al. (1998) acrescentaram à cardiomiotomia a divulsão das bordas musculares, associada à esofagogastropexia. Relataram 50 casos operados, com seguimento de seis meses a 7,6 anos. Os resultados foram considerados como ótimo em 86% e bom em 14% dos casos (55).
Rassi (1964) utilizava um balão tipo Sengstaken-Blakemore, que era introduzido via nasal durante o ato cirúrgico e mantido insuflado durante as primeiras 24 horas, com dupla finalidade: evidenciar se a secção das fibras musculares circulares foi completa e manter afastadas as bordas da ferida no pós-operatório imediato. Relatou 63 casos operados com esta técnica, com bons resultados (65). Posteriormente (1967) padronizou a cardiomiotomia com esofagogastropexia à Lortat-Jacob, relatando sua experiência com 236 casos operados no período de 10 anos (1967-1977). Do total, 86 pacientes foram acompanhados nesse período, com bons resultados tardios em 88,4% dos casos.
Apesar das numerosas modificações na técnica original de Heller, firmou-se, entretanto, na literatura médica, a denominação genérica de operação de Heller para qualquer de suas variantes.
A cardiomiotomia é normalmente utilizada nos casos não avançados de megaesôfago. Nos casos avançados seus resultados não são satisfatórios e prefere-se outro tipo de operação. O grande aumento de diâmetro do órgão, a atonia de suas paredes e seu alongamento, dobrando-se sobre a cúpula diafragmática direita, resulta na formação de uma bolsa estagnante que retém grande parte dos alimentos ingeridos.
Recentemente, Pinotti (1999) propôs associar nestes casos a cardiomiectomia com fundoplicatura à ressecção de uma faixa longitudinal da parede ântero-lateral direita do esôfago, o que reduz o diâmetro do órgão e verticaliza a sua luz, facilitando o seu esvaziamento. Tudo indica que esta conduta mais conservadora poderá substituir as operações mais agressivas no tratamento cirúrgico do megaesôfago avançado (56)
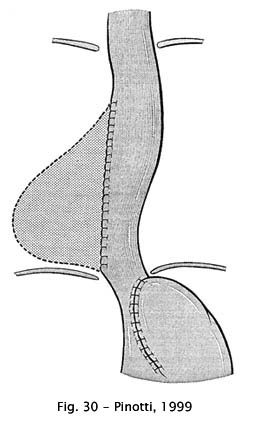
Fig 30 – Pinotti, 1999
Com o advento da cirurgia laparoscópica, a cardiomiotomia extramucosa com fundoplicatura, tanto na acalásia idiopática, como no megaesôfago chagásico, tem sido realizada de preferência utilizando-se deste novo método cirúrgico, com todas as vantagens que lhe são inerentes: menor tempo de hospitalização, pós-operatório mais confortável para o paciente, mobilização precoce e ausência de cicatriz abdominal extensa.
Na experiência mundial, os resultados obtidos com a cirurgia laparoscópica no tratamento da acalásia são equivalentes aos da cirurgia laparotômica convencional (16,17,21). Os cirurgiões também não encontram maiores dificuldades técnicas; ao contrário, a abordagem cirúrgica da região cárdica é facilitada pela ampliação da m do campo operatório.
Procedimentos anti-refluxo
Muito embora a incidência de esofagite de refluxo pós-operatória seja menor com a cardiomiotomia do que com as cardioplastias clássicas, ainda assim o número de pacientes que apresentam esta complicação é significativo, o que levou os cirurgiões a complementar a operação com algum procedimento anti-refluxo.
Um dos recursos inicialmente utilizados foi o de proceder à vagotomia, para redução da secreção ácida do estômago, associada ou não à piloroplastia, para facilitar o esvaziamento gástrico.
Um melhor conhecimento do mecanismo de contenção do refluxo em indivíduos normais levou os cirurgiões a idealizarem outros procedimentos capazes de criar uma barreira anatômica anti-refluxo, de natureza valvular, na própria transição esofagogástrica, à semelhança da conduta seguida na correção das hérnias hiatais.
Lortat-Jacob (1953) foi dos
primeiros a valorizar a acentuação do ângulo de His
na prevenção do refluxo em pacientes submetidos à
cardiomiotomia, preconizando a fixação do fundo gástrico
à borda esquerda do esôfago por meio de uma fileira de pontos
separados (45), como mostra a figura 31.
.
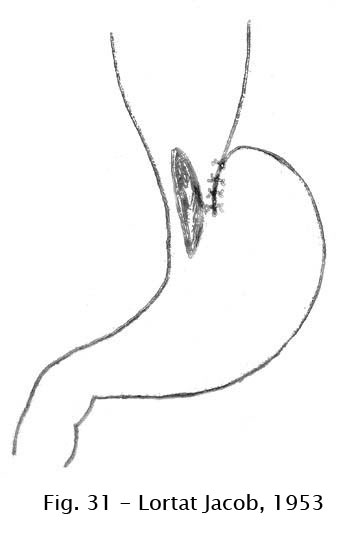
Fig 31 – Lortat-Jacob, 1953
Nissen e Rossetti (1962) divulgaram a operação, que ficou conhecida pelo seu epônimo, para o tratamento da hérnia hiatal e esofagite de refluxo, a qual poderia ser empregada como complemento da cardiomiotomia no tratamento cirúrgico da acalásia (52). Nesta operação, o esôfago distal fica envolvido pelo fundo gástrico em toda a circunferência, como mostra a figura 32.
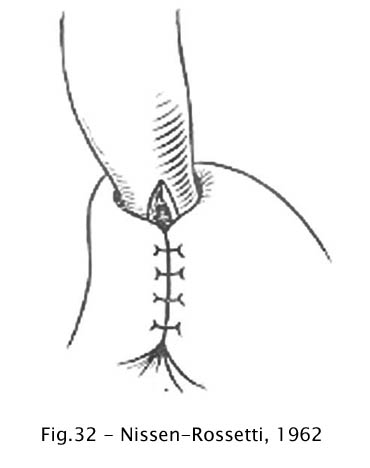
Fig 32 – Nissen-Rossett, 1962
De eficácia comprovada na prevenção do refluxo, quando utilizada na acalásia dificulta o esvaziamento do esôfago pela falta de peristaltismo esofagiano que caracteriza esta afecção, causando persistência da disfagia.
A fundoplicatura total foi então substituída pela fundoplicatura parcial e diversas técnicas foram propostas para realizá-la.
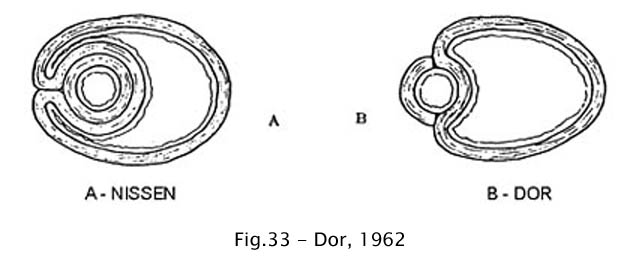
Dor et al.(1962) descreveram a técnica que eles mesmos apresentaram como sendo uma modificação da operação de Nissen para hérnia hiatal. Na operação de Dor et al., após a miotomia em uma extensão de 8 a 10 cm, o bordo direito do fundo gástrico é suturado ao bordo esquerdo da incisão. A seguir procede-se a uma segunda sutura, unindo a face anterior do fundo gástrico com o bordo direito da incisão, de modo a recobrir em 180o toda a superfície exposta da mucosa esofagiana (18). A figura 33 reproduz a ilustração original do trabalho de Dor, na qual os autores comparam o aspecto, em corte transversal, da operação de Nissen com a técnica por eles descrita.
Toupet (1963) apresentou à Academia de Cirurgia da França uma operação análoga, que difere da operação de Dor por realizar a gastroesofagopexia na face póstero-lateral do esôfago e não na face anterior. Além disso, faz-se a fixação por pontos separados do fundo gástrico ao diafragma (83).

Fig 34 – Toupet, 1963
Jekler e Lhotka (1967) modificaram a técnica de Dor, acrescentando à mesma a fixação do fundo gástrico ao esôfago, um a dois cm acima da comissura superior, com o objetivo de acentuar ainda mais o ângulo de His (38)
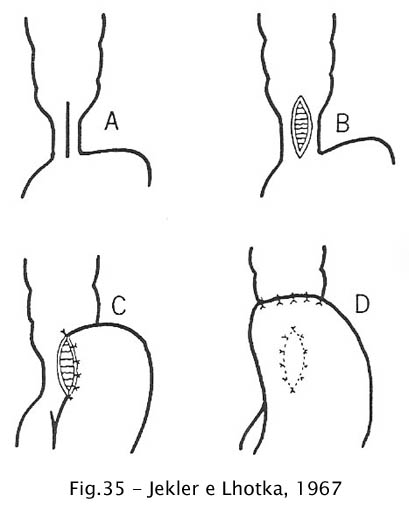
Fig 35 – Jekler e Lhotka, 1967
Pinotti et al., insatisfeitos com os resultados obtidos com as técnicas de Dor e de Jekler e Lhotka, metodizaram um procedimento anti-refluxo em que a gastroesofagopexia abrange a face posterior, a partir do eixo longitudinal, a face esquerda e a face anterior do esôfago, envolvendo-o numa altura de 5 a 6 cm em cerca de dois terços de sua circunferência. Na técnica por eles descrita faz-se a miotomia com a retirada de uma fita da parede muscular da face anterior do esôfago, de 0,5 a 1,0 cm de largura, estendendo-se 3 cm abaixo e 6 cm acima da transição esofagogástrica.
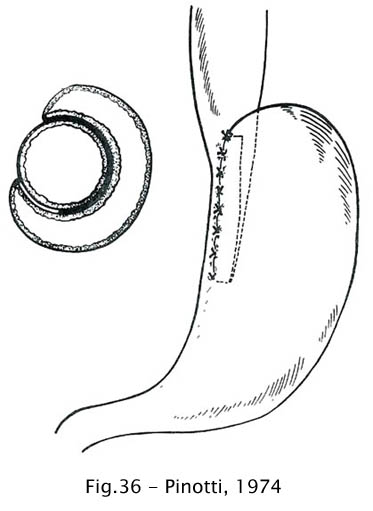
Fig 36 – Pinotti, 1974
Feita a miotomia, a face posterior do fundo gástrico é fixada à parede posterior do esôfago. A seguir, é feita a fixação da parede anterior do fundo gástrico sucessivamente nas bordas esquerda e direita da incisão, de modo a mantê-las afastadas e a proteger a mucosa exposta. Nos casos em que o hiato se apresenta com diâmetro superior a 4 cm realiza-se a aproximação dos braços do pilar medial do diafragma com pontos separados (57).
Na literatura internacional os procedimentos anti-refluxo mais citados são o de Dor e o de Toupet, especialmente o primeiro, talvez pela maior facilidade de sua execução na cirurgia laparoscópica, enquanto na literatura brasileira predomina de modo absoluto a técnica de Pinotti e colaboradores.
Esofagectomia subtotal
A esofagectomia subtotal consiste na retirada do esôfago, à exceção do segmento proximal do esôfago cervical, que será anastomosado ao estômago ou a um segmento do cólon para reconstrução do trânsito.
Como opção cirúrgica para o tratamento do megaesôfago, a esofagectomia subtotal foi praticada pela primeira vez por Câmara-Lopes em 1955. A operação, que ficou conhecida pelo nome do seu autor, reconstitui o trânsito com o estômago por via mediastinal anterior retroesternal extrapleural (9). Posteriormente, Ferreira Santos modificou a técnica original, passando a fazer a reconstituição do trânsito por via transmediastinal posterior, conduta esta que passou a ser preferida por outros cirurgiões.
Rassi (1979), com grande experiência em cirurgia do megaesôfago, restringiu a esofagectomia subtotal aos casos de dolicomegaesôfago e preferiu utilizar o cólon transverso em lugar do estômago, por via retroesternal. Relatou 113 casos de esofagocoloplastia, com dois óbitos (65).

Fig 37 – Rassi, 1973
Eugênio Ferreira (1975) desenvolveu uma nova técnica de esofagogastroplastia transmediastinal posterior, utilizando a via cervicoabdominal, sem toracotomia. Nesta operação, após a secção do esôfago em sua porção cervical e extremidade distal, bem como a liberação das duas bocas das estruturas vizinhas, o esôfago torácico é retirado com um extrator metálico, a exemplo dos que são usados nas operações de safenectomia (22).
Segundo Pinotti, técnica semelhante fora empregada anteriormente por Ach, na Alemanha, em 1913, no tratamento do câncer do esôfago (56).
Pinotti (1976) divulgou a técnica por ele concebida de esofagectomia sem toracotomia, utilizando a via de acesso por "transecção mediana do diafragma", o que trouxe um grande avanço na cirurgia do esôfago, de modo geral, e do megaesôfago avançado, em particular. Esta técnica teve repercussão internacional e está sendo adotada em grandes centros cirúrgicos do exterior. No período de 1974 a 1997 haviam sido submetidos à esofagectomia trans-hiatal no Hospital das Clínicas da Universidade de São Paulo 155 pacientes portadores de megaesôfago avançado (56).
Aquino et al. (2000) descreveram outra modalidade de operação para os casos de megaesôfago avançado, na qual também utilizam a via cervicoabdominal, sem toracotomia. Consiste na retirada da mucosa esofagiana por descolamento da submucosa, preservando-se a túnica muscular do esôfago no mediastino. A reconstrução do trânsito é feita pela transposição do estômago através do tubo muscular remanescente. Os autores apresentam uma casuística de 60 casos operados com bons resultados e baixa morbidade pós-operatória (3).
Contribuição brasileira
O tratamento cirúrgico do megaesôfago no Brasil teve início em 1922, quando Walter Seng, em São Paulo, realizou com sucesso a operação de Heller em dois pacientes (76). Três anos depois, Raphael Parisi, em sua tese inaugural, relata 17 casos operados por cardiomiotomia, onze dos quais por A.C.Camargo (13). Até 1933, este cirurgião já havia operado cerca de 200 casos (13).
Desde então o tratamento cirúrgico do megaesôfago passou a ser feito em outros centros médicos do País e a cardiomiotomia passou a integrar o rol das operações realizadas pelos cirurgiões gerais, não somente nas capitais, como também em cidades do interior dotadas de maiores recursos.
O caráter endêmico da doença de Chagas no Brasil e o grande número de pacientes que evoluem com a forma digestiva proporcionaram aos cirurgiões brasileiros a maior casuística mundial no tratamento do megaesôfago e do megacólon adquirido.
A contribuição brasileira à cirurgia do megaesôfago chagásico e, obviamente, da acalásia idiopática, se traduz, tanto no aprimoramento das técnicas tradicionais utilizadas em outros países, como, principalmente, pela inovação, com operações originais.
Em razão da maior prevalência da esofagopatia chagásica nos estados de São Paulo, Minas Gerais, Goiás e Distrito Federal, os cirurgiões destes estados, com base na grande experiência adquirida, idealizaram e descreveram novas soluções cirúrgicas para o tratamento do megaesôfago.
Em São José do Rio Preto, Serra-Dória concebeu a operação que ficou conhecida pelo seu nome. Em Ribeirão Preto, Câmara-Lopes e Ferreira-Santos realizaram pela primeira vez no tratamento do megaesôfago, a esofagectomia subtotal com esofagogastroplastia retroesternal extrapleural, operação esta modificada posteriormente por Ferreira-Santos, que optou pela via mediastinal posterior. Em Belo Horizonte, José Sílvio Resende e Alcino Lázaro da Silva aprimoraram a técnica da operação de Merendino e Dillard. Também em Belo Horizonte, Thomaz de Aquino França e colaboradores descreveram uma nova modalidade de cardioplastia. Em Goiânia Luiz Rassi adotou um critério seletivo da técnica cirúrgica a ser empregada, com base na classificação radiológica de Rezende et al. (69), indicando a cardiomiotomia com esofagogastropexia à Lortat-Jacob para os casos dos grupos II e III, sem esofagite; interposição de alça jejunal em pacientes tratados anteriormente por dilatação ou cirurgia, com esofagite, e esofagectomia com esofagocoloplastia para os casos do grupo IV (dolicomegaesôfagos). Em Brasília, a cardioplastia de Thal Hatafuku teve seus seguidores em Barbosa et al. e Ximenes Neeto, que modificaram e aprimoraram esta operação. Em Campinas, SP, José Luiz Braga de Aquino e colaboradores descreveram uma nova operação para o megaesôfago avançado: a mucosectomia do esôfago, com preservação da parede muscular do esôfago torácico e esofagogastroplastia mediastinal posterior.
A maior contribuição se deve à escola paulista, representada por Correia Neto, Arrigo Raia, Henrique Walter Pinotti e outros cirurgiões que se dedicaram ao estudo e ao tratamento cirúrgico do megaesôfago.
Maior destaque deve ser dado à contribuição de Henrique Walter Pinotti, que abrange estudos de fisiopatologia, clínica e cirurgia do megaesôfago. Introduziu ele o procedimento anti-refluxo que recebeu o seu nome e cuja eficiência suplantou aos já descritos por outros autores. Idealizou e padronizou a esofagectomia por transecção mediana do diafragma, a qual também se aplica a outras afecções do esôfago, como o câncer e a estenose cicatricial
Recentemente inovou com outra operação mais conservadora para o megaesôfago avançado, que associa a cardiomiotomia à ressecção de uma faixa longitudinal da parede do esôfago, com a redução do calibre deste e retificação de sua luz.
A casuística global de cirurgia do megaesôfago no Brasil soma milhares de casos. Todavia, a maioria dos cirurgiões não divulgam os seus dados, o que impede uma avaliação correta. As publicações existentes relatam em geral a casuística pessoal do cirurgião e sua equipe em determinado período de tempo e não refletem o universo dos casos operados.
Por esta breve revisão
histórica tem-se idéia de como evoluiu a cirurgia da acalásia
e do megaesôfago chagásico. Diferentes condutas e tipos de
operação foram usados no passado, fundados em hipóteses
etiopatogênicas sem comprovação científica.
Com base nos conhecimentos adquiridos sobre a patogênese e a fisiopatologia
da afecção aceita-se atualmente a cardiomiotomia, com algum
tipo de fundoplicatura parcial, como a operação mais indicada
para os casos de megaesôfago não avançado. Para os
casos avançados ainda não há um consenso entre os
cirurgiões e diferentes operações são preconizadas.
Different kinds of surgical operations which have been proposed are separated in eleven different groups, considering their theoretical backgrounds and surgical techniques.
Given the lack of knowledge of achalasia pathophysiology, past surgical approaches varied according to the surgeon's own interpretation of the disease. As a consequence, a great number of surgical interventions were done which nowadays have only historical interest.
The recent surgical treatment could only be developed after advances in knowledge of the pathogenesis and pathophysiology of achalasia were reached.
Cardiomyotomy with some partial fundoplication is currently considered the preferred surgical technique in non advanced megaesophagus cases. For those with large esophageal dilation and elongation, there is no consensus among surgeons about which would be the most appropriated operation.
The large expertise and contributions
to the surgical treatment of megaesophagus from Brazilian surgeons, either
improving the common operations or creating new ones, are highlighted.
Referências bibliográficas
2. ANSCHÜTZ - Discussion Verh. Deutsch. Ges. Chir. 45: 117 , 1921. Apud Ellis e Olsen (19).
3. AQUINO JLB, REIS NETO JA, MURARO CLPM, CAMARGO JGT. Mucosectomia esofágica no tratamento do megaesôfago avançado; análise de 60 casos. Rev. Col. Bras. Cir. 27:109-116, 2000.
4. BACKER-GRÖNDHAL N. Kardioplastik ved cardiospasmus. Nord. Kirurgiski. Forenings 11:236-240, 1916. Apud Ellis e Olsen (19).
5. BARBOSA H., OLIVEIRA, CACP, PEREIRA MG et al. Cardiectomia com interposição ileocecal no tratamento do megaesôfago chagásico. Arq. Gastroenterol. 8:171-182, 1971.
6. BARBOSA H., BARICHELLO AV, VIANNA, AV, et al. Tratamento cirúrgico do megaesôfago chagásico: duas décadas de experiência numa região endêmica. Rev. Goiana Med. 35:1-23, 1987.
7. BARRETT, NR, FRANKLIN, RH Concerning the unfavourable late results of certain operations performed in the treatment of cardiospasm. Brit. J. Surg. 37:194-202, 1949.
8. BIER - Citado por PRIBRAM (60).
9. CÂMARA-LOPES, .H, FERREIRA-SANTOS R. Indicação seletiva do processo de Heller, da ressecção parcial e da ressecção subtotal do esôfago no tratamento cirúrgico do megaesôfago. Rev. Paul. Med. 52:269-275, 1958.
10. CHAIB, SA, LOPASSO, FP, PARRA, OM et al. Tratamento do megaesôfago pela técnica de Heller-Vasconcelos. Experiência em 200 casos. Rev. Hosp. Clin. Fac. Med. São Paulo 32:178- 1977.
11. CHAIB, SA Tratamento cirúrgico do megaesôfago, uma nova modificação da operação de Heller. Rev. Col. Bras. Cir. 10:169-173, 1983.
12. CIAGLIA, P, SEGAL, G.- Segmental esophagectomy: ancillary procedure for advanced megaesophagus with sigmoid elongation. J. Thorac. Cardiov. Surg. 44:44-52, 1962.
13. CORREIA NETO, A. Patogenia, Diagnóstico e Tratamento do megaesôfago (Mal de engasgo). Cia. Editora Nacional, São Paulo, 1935.
14. COUTO Jr., D, ALDROVANDO, J. Tratamento cirúrgico do megaesôfago pela esofagectomia parcial e interposição de segmento de colon. Folha Med. 53: 913-912, 1966.
15. CRAIG, WM, MOERSCH, HJ, VINSON, PP. Treatment of intractable cardiospasm by bilateral cervicothoracic sympathetic ganglionectomy. Report of a case. Proc. Staff Meet Mayo Clin. 9:749-753, 1934.
16. DELGADO F, BOLUFER JM, MARTINEZ-ABAD M et al. - Laparoscopic treatment of esophageal achalasia. Surg. Laparosc. Endosc. 6:83-90, 1996.
17. DOMENE CE, SANTO MA, ONARI P. et al. Cardiomiectomia com fundoplicatura parcial videolaparoscópica no tratamento do megaesôfago não avançado: estudo de 50 casos. Rev. Col. Bras. Cir. 25:229-234, 1998.
18. DOR J, HUMBERT P, DOR V, FIGARELLA, J. L'intérêt de la technique de Nissen modifiée dans le prévention du reflux après cardiomyotomie extramuquese de Heller. Mém Acad Chir 27:877-883, 1962.
19. ELLIS Jr. H, OLSEN AM. Achalasia of the esophagus. Philadelphia, W.B. Saunders Co., 1969.
20. ENDERLEN - Discussion. Arch. Klin. Chir. 157, 138, 1929. Apud Ellis e Olsen (19)
21. ESPOSITO, PS, SOSA JL, SLEEMAN D, SANELICES AA - Laparoscopic management of achalasia. Am. Surg. 3:221-323, 1997.
22. FERREIRA EAB. Esofagectomia subtotal e esofagogastroplastia transmediastinal posterior sem toracotomia no tratamento do megaesôfago. Tese Fac. Med. Univ. São Paulo, 1975.
23. FONTAINE R, FRANK, P. La cardio-oesophagostomie extra-muquese élargie par voie intra-thoracique et associée àla résecion de3s splanchnique et sympathiquedorsaux gauchs dans le tratiemente du mega-oesphage. A propos de 6 cas personels. Mém. Acad. Chir. (Paris) 76:216-223, 1950.
24. FRANÇA TA, GUEDES FILHO N, BERINDOAGUE NETO R, SILVA AL. Esofagocardiomioplstia transversal extra-mucosa mais esofagogastrofundoplicatura parcial no tratamento do megaesôfago. Rev. Col. Bras. Cir. 26:219-226, 1999.
25. FREEMAN L. An operation for the relief of cardiospasm associated with dilatation and tortuosity of the oesophagus. M. Sur. 78:173-175, 1923. .Apud Ellis e Olsen (19).
26. FREJAT J. Contribuição ao tratamento cirúrgico do megaesôfago. Brasília Médica 10:25-30, 1974.
27. GIRARD - Discussion. Ver. Med. Suisse Rom. 35280-281, 1915. Apud Vantrappen e Hellemans. (88).
28. GOLDENBERG S, OLIVEIRA E, AMARAL JR, HERANI FILHO B. Conduta cirúrgica para a esofagite por refluxo gastresofágico. Aplicação no tratamento cirúrgico do megaesôfago. Rev.. Ass. Med. Bras. 18:409-414, 1972.
29. GRAHAM A.J., FINLEY RAJ, WONSLEY DE et al. Laparoscopic esophageal myotomy and anterior partial fundoplication for the treatment of achalasia. Ann. Thorac. Surg. 64:785-789, 1997.
30. GREGOIRE R. Pathogénie et traitement de la dilatation idiopathique de l'oesophage. Arch. MaL. App. Dig. 14:455-469, 1924.
31. GROENVELDT, FRB. Over cardiospasmus. Nederl. T. Genesk. 2:1281, 1918. Citado por Zaaijer (94).
32. GUARNER V., GAVIÑO J. The Heyrowsky operation associated with fundoplicaarion for the treatment of patients with achalasia of the esophagus after failure of the cardiomyotomy. Surg. GineC. Obst. 157:459-454, 1983.
33. HELLER E. Extramuköse Cardioplastik beim chronischen Cardiospasmus mit Dilatation des Oesphagus. Mitt. Grenzgeb. Med. Chir. 27: 141-149, 1913. Apud Ellis e Olsen (19).
34. HERTZ AF. Achalasia of the cardia. Quart. J. Med. 8, 300-308, 1914/1915.
35. HEYROWSKY H. Casuistik und Therapie der idiopathischen Dilatation der Speiseröhre. Oesophagogastroanastomose. Arch. Klin. Chir. 100:703-715, 1913.
36. HOLT CJ, LARGE AM - Surgical management of reflux esophagitis. Ann Surg. 153:555-562, 1961..
37. HURST AF, RAKE GW. Achalasia of the cardia (so-called cardiospasm). Quart. J. Med. 23: 491-508, 1930.
38. JEKLER J, LHOTKA. Modified Heller procedure to prevent postoperative reflux esophagitis in patients with achalasia. Am. J. Surg. 113: 251-254, 1967.
39. KAY EB. Surgical treatment of cardiospasm. Ann. Surg. 127:34-39, 1948.
40. KELLER WL. Operative relief of cardiospasm where dilatation has failed. Ann. Surg. 88:58-64, 1928.
41. KNIGHT GC Sympathectomy in the treatment of achalasia of the cardia. Brit. J. Surg. 22:864-876, 1935.Apud Knight e Adamson (42).
42. KNIGHT GC, ADAMSON WD. Achalasia of the cardia. Proc. Roy. Soc. Med. 28:891-897, 1935.
43. KÜMMELL H. Zur operation des Kardiospasmus und des Oesophaguscarcinoms. Arch.Klin. Chir. 177:193-204, 1921 .Apud Ellis e Olsen (19).
44. LAMBERT AVS. Oesophago-gastrotomy for cardiospasm. Ann. Surg. 58:425-418, 1913 Apud Ellis e Olsen (19).
45. LORTAT-JACOB, JL. Traitement chirurgical du cardiospasme. Semaine h}op. Paris 10:1- , 1953.
46. MALAFAIA O. Tratamento cirúrgico do megaesôfago avançado pela cardioplastia à Thal. In Leonardi, LS - Controvérsias na cirurgia do aparelho digestivo. São Paulo, MEDSI, 1991, 38. Apud XIMENES NETTO, M. (94).
47. MARTIN E. Zur Chirurghischen Behandlung Des Cardiospasmus und der Spindelförmigen Speiseröhrerveiterung. Mitt. Grenzgeb. Med. u. Chir. 8: 226-246, 1907. Apud Ellis e Olsen (19).
48. MATTOS JO. Tratamento cirúrgico do megaesôfago. Arq. Hosp. Santa Casa São Paulo 1: 37-64, 1955.
49. MERENDINO KA, DILLARD DH. The concept of sphincter substitution by an interposed jejunal segment for anatomic and physiologic abnormalities as at the esophagogastric junction. Ann. Surg. 142: 486-509, 1955.
50. MEYER W. Impermeable cardiospasm successfully treated by thoracothomy and esophagoplication. JAMA 56: 1437-1438, 1910.
51. MIKULICZ J Von. Zur pathologie und therapie des cardiospasmus. Deutsch. Med. Wochsch 30: 17-19; 50-54, 1904.
52. NISSEN R, ROSSETTI M. Chirurgie de la hernie hiatale et dy syndrome de reflux: la fundoplicature et la gastropexia. J. Chir. (Paria) 83:659-671, 1962.
53. OCHSNER A, DeBAKEY M. The surgical considerations on achalasia. Review of the literature and report of three cases. Arch. Surg. 41:1146-1183, 1940.
54. PETROVSKY B. Cardiospasm and its surgical correction. Ann. Surg. 155:60-71, 1962.
55. PILON B, TEIXEIRA FV, TERRAZAS JPI et al. Aspectos técnicos da esofagocardiomiotomia com divulsão para o tratamento cirúrgico do megaesôfago chagásico não avançado. Rev. Ass. Méd. Bras. 44:179-184, 1998.
56. PINOTTI HV. Acesso ao esôfago torácico por transecção mediana do diafragma. São Paulo, Atheneu, 1999.
57. PINOTTI HV, ELLENBOGEN G., GAMA-RODRIGUES, J.J. et al. Novas bases para o tratamento cirúrgico do megaesôfago: esofagocardiomiotomia com esofagofundogastropexia.. Rev. Ass. Med. Bras 20:331-334, 1974.
58. PINOTI HW, ELLENBOGEN G, GAMA-PRODRIGUES, J.J, RAIA A. Tratameanto cirúrgico do megaesôfago pela técnica de esofagocardiomiotomia com esofagofundogastropexia. Observações tardias sobre 118 casos operados. Rev. Ass. Méd. Bras. 24:899-90, 1978.
59. PLUMMER HS. Cardiospasm, with report of cases. Lancet 26:419-424, 1906.
60. PRIBRAM BO. Zur pathologie and Chirurgie der spastischen Neurosen. Arch. Klin. Chir. 120:207-261, 1922.
61. RADLINSKI. Observations de chirurgie oesophagienne. Bruxelles Med. 17:202-203, 1936
62. RAIA AA. Manifestações digestivas da moléstia de Chagas. São Paulo, Sarvier, 1983.
63. RAIA AA, PINOTTI HW, GAMA-RODRIGUES JJ. - Operação de Merendino. In RAIA A (62)
64. RASSI L. Resultados do tratamento cirúrgico do megaesôfago chagásico com uma variante de Heller. Rev. Goiana Med. 11:49-57, 1965.
65. RASSI L. Critério seletivo na indicação da técnica cirúrgica para o megaesôfago chagásico. Rev. Goiana Med. 25:85-104, 1979.
66. RECALDE JF. Cardiospasmo, dysphagia e mega-esophago (Mal de engasgo). Bol. Soc. Med. Cir. São Paulo 15:36-64, 1931.
67. REISINGER M. Über die operative behandlung der Erweiterung des oesophagus. Verhandl. De Deutsch. Ges. Chir. 36:86-88, 1907. Apud Vantrappen & Hellemans ( 88 )
68. RESENDE JS. Tratamento cirúrgico do megaesôfago. Operação de Merendino. Rev Goiana Med. 19:169-184, 1973.
69. REZENDE JM, LAUAR KL, OLIVEIRA AR. Aspectos clínicos e radiológicos da aperistalsis do esôfago. Rev. Bras. Gastroenterol. 12: 247-262, 1960.
70. RIEDER W. Der sogenannte Cardiospasmus. Eine - idem experimentelle Studie. Deutsch. Z. Chir. 217:334-358, 1929.
71. RIPLEY HR, OLSEN AM, KIRKLIN JW. Esophagitis after esophagogastric anastomosis. Surgery 32: 1-9, 1952.
72. ROEPKE. Zur Operation des Oesophagospasmus. Verh. Deutsch. Ges. Chiar. 43:121-122, 1914.Apud Vantrappen e Helllemans (88).
73. RUSSELL JC. Diagnosis and treatment of spasmodic stricture of the esophagus. Brit. Med. J. 1: 1450-1451, 1898.
74. SADER AA ,CARNEIRO, JJ, BRASIL, JCF, et al. Gastroesofagoplastia de Thal modificada paara o tratamento do megaesôfago. Rev .Ass. Med. Bras. 21:72-76, 1975.
75. SAUERBRUCH F. Discussion. Verh. Deutsch. Ges. Chir. 45, 129, 1921. Apud Ellis e Olsen (19).
76. SENG W. Cirurgia do esophago. Bol. Soc. Med. Cir. São Paulo 5:128-133, 1922.
77. SERRA-DÓRIA OB, DÓRIA OMS, DÓRIA ORS. Nova conduta para o tratamento do megaesôfago. Rev. Soc. Med. Cir. São José Rio Preto 1: 11-15, 1968.
78. SERRA-DÓRIA O. Tratamento cirúrgico do megaesôfago. Operação de Serra-Dória. Rev.Goiana Med. 19:185-193, 1973.
79. SILVA AL, CONCEIÇÃO SAS, ALVARENGA ML . Interposição de alça jejunal no tratamento cirúrgico do megaesôfago chagásico, análise do pós-operatório imediato. Rev, Ass. Méd. Bras.33:94-98, 1987.
80. STEFANI-NAKANO, SM. Avaliação dos resultados tardios de megaesôfago chagásico avançado operado pela técnica de esofagectomia com gastroplastia e operação de Serra Dória: estudo clínico, nutricional, endscópico, anatomopatológico e avaliação da qualidade de vida. Tese doutorado Fac. Med. Univ. São Paulo, 2005.
81. STEICHEN FM, HELLER E, RAVITCH MM. Achalasia of the esophagus. Recent adv. surg. 47:846-876, 1960.
82. THAL AP, HATAFUKU T, KURTZMAN R. New operation for distal esophageal stricture. Arch. Surg. 90: 464-472, 1965.
83. TOUPET A. A technique d’oesophago-gastroplastie avec phréno-gastropexie appliquée dans la cure radicale des hernies hiatales et comme complément de l’opération de Heller dans les cardiospasmes. Mem Acad Chir 1963; 394-399.
84. TREVENZOL HP. Operação de Serra-Dória no tratamento do megaesôfago operado, com recidiva dos sintomas. Dissertação de Mestrado. Fac. Med. Univ. São Paulo, 2003.
85. TUFFIER, M. Dilatation de l'oesophage. Megaesophage. Operation. Résultat fonctionnel suivi sur radiography huit mois après. Bull. Mém. Soc. Chir. (Paris) 48:446-450, 1922. Apud Vantrappen & Hellemans (88).
86. VAMPRÉ E. - Contribuição ao Estudo do mal de engasgo. São Paulo, Serviço Sanitário do Estado de São Paulo, 5, 1919 p. 3-73.
87. VAMPRÉ E. Terceira contribuição ao estudo do mal de engasgo. Bol. Soc. Med. Cir. São Paulo 6: 75-88, 1923.
88. VANTRAPPEN G., HELLEMANS J. Diseases of the esophagus. Berlin, Springer-Verlag, 1974.
89. VAZ MGM. Contribuição ao estudo clinico, radiológico e endoscópico do megaesôfago chagásico. Dissertação de Mestrado. Instituto de Patologia Tropical e Saúde Publica da Universidade Federal de Goiás, 1991.
90. WAKELEY CPG. A case of hiatal esophagismus in man aged thirty-six years. Brit. Med. J. 1:589-590, 1916.
91. WANGENSTEEN OW. A physiologic operation for mega-esophagus: (dystonia, cardiospasm, achalasia. 134:30-315, 1951.
92. WENDEL, W. Zur Chirurgie des Oesophagus. Arch. F. Klin. Chir. 9:311-329, 1910.
93. XIMENES NETTO M - Megaesophagus. Current review of techniques and results. Saúde, Brasília 2:207-236, 1991.
94. ZAAIJER JH Cardiospasm in the aged. Ann. Surg. 77:615-617,
1923.
Joffre M de Rezende
Prof. Emérito da Faculdade de Medicina da Universidade
Federal de Goiás
Membro da Sociedade Brasileira de História da Medicina
e-mail: pedro@jmrezende.com.br
http://www.jmrezende.com.br